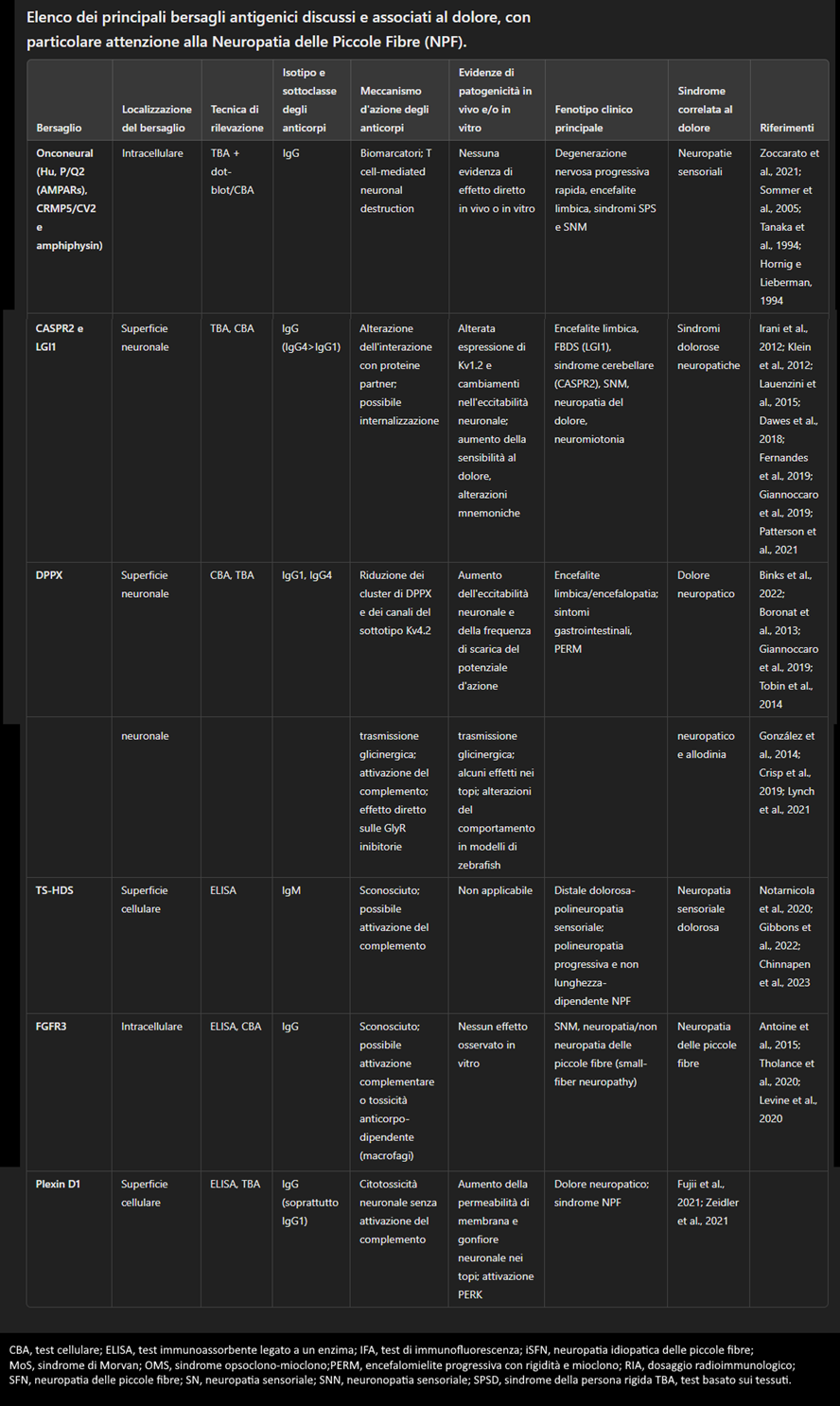
Attività di formazione continua
La neuropatia delle piccole fibre si presenta con dolore urente, che spesso inizia a livello degli arti, principalmente dei piedi. È dovuta al coinvolgimento delle fibre nervose A-delta e C. Può avere un’origine idiopatica o avere cause metaboliche, ereditarie, infettive, immunomediate o tossiche. Deve essere prontamente diagnosticata e trattata per evitare dolore, debilitazione o il possibile coinvolgimento delle grandi fibre nervose. Questo articolo riesamina la valutazione e il trattamento della neuropatia delle piccole fibre ed evidenzia il ruolo di un team interprofessionale nella valutazione e nel trattamento dei pazienti affetti da questa malattia.
Obiettivi:
- Identificare le diverse eziologie della neuropatia delle piccole fibre.
- Riesaminare la corretta valutazione della neuropatia delle piccole fibre, includendo l’anamnesi del paziente e i risultati degli esami.
- Delineare le opzioni di trattamento disponibili per la neuropatia delle piccole fibre.
- Descrivere le strategie che il team interprofessionale deve mettere in atto per migliorare la coordinazione delle cure e la comunicazione e, di conseguenza, gli esiti nella neuropatia delle piccole fibre.
Introduzione
La neuropatia periferica è un problema comune, che si stima colpisca da 15 a 20 milioni di persone di età superiore a 40 anni negli Studi Uniti.[1] È la causa più comune di visite neurologiche ambulatoriali negli Stati Uniti ed è responsabile di una spesa sanitaria superiore a 10 miliardi di USD ogni anno.[2]
In molti soggetti colpiti, queste neuropatie coinvolgono le piccole fibre nervose, incluse le fibre Aδ periferiche sottilmente mielinizzate oltre alle fibre nervose C non mielinizzate.[3] Il coinvolgimento di queste piccole fibre nervose, a cui si fa riferimento con il termine di neuropatia delle piccole fibre (NPF), tipicamente si presenta con dolore, bruciore, intorpidimento e formicolio, spesso con una distribuzione a calza e a guanto, con sintomi che generalmente iniziano dai piedi e salgono verso l’alto.
Eziologia
La neuropatia delle piccole fibre colpisce le piccole fibre Aδ mielinizzate e le fibre C non mielinizzate.[4] La NPF può colpire sia le fibre somatiche che quelle autonomiche, portando ad alterazioni sensoriali, disfunzione autonomica o una combinazione di sintomi.[5]
Le piccole fibre nervose autonomiche trasmettono segnali termoregolatori, cardiovascolari, gastrointestinali, sudomotori, urogenitali e altri segnali autonomici, mentre le piccole fibre nervose somatiche trasmettono informazioni riguardanti dolore, temperatura e prurito.[6]
I sintomi generali della NPF includono stanchezza, disturbi cognitivi, cefalea e dolore muscoloscheletrico diffuso e quindi possono avere un impatto negativo sulla qualità della vita. La NPF è associata a moltissime malattie ma può anche presentarsi come idiopatica. Le eziologie della NPF possono essere suddivise in sei categorie.[7]
Ereditarie
- Malattia di Fabry
- Mutazione dei canali del sodio
- Malattia di Wilson
- Amiloidosi familiare
Infettive
Tossiche
- Alcool
- Chemioterapia
- Farmaci neurotossici
- Vaccini
Immunomediate
- Ehlers-Danlos
- Fibromialgia
- Gammopatia monoclonale
- Neuropatia delle piccole fibre infiammatoria acuta
- Lupus
- Malattia del tessuto connettivo
- Polineuropatia demielinizzante infiammatoria cronica
- Sarcoidosi
- Malattie reumatiche (disturbi indifferenziati del tessuto connettivo, artrite reumatoide, artropatia psoriasica)
- Sindrome di Sjögren, amiloidosi sistemica primaria
Metaboliche
- Diabete mellito
- Alterata tolleranza al glucosio
- Carenza di vitamina B12
- Carenza di rame
- Funzionalità tiroidea anormale
Idiopatiche
Epidemiologia
Uno studio retrospettivo epidemiologico trasversale sulla NPF condotto nei Paesi Bassi ha riscontrato un’incidenza di 12 casi per 100.000/anno, con una prevalenza di 53 casi per 100.000. Questo studio ha riscontrato che la NPF è osservata più comunemente negli uomini e diagnosticata più frequentemente in pazienti di età superiore a 65 anni.
Questi tassi di malattia sono probabilmente sottostimati a causa della scarsa consapevolezza e della mancanza di criteri diagnostici standardizzati, e si prevede aumenteranno nei prossimi anni con l’aumentare della consapevolezza della NPF.[8]
Fisiopatologia
I nervi del sistema nervoso periferico sono classificati in diversi tipi in base a una moltitudine di fattori, tra cui diametro, mielinizzazione e velocità di conduzione (vedere la Tabella 1). Le fibre Aα e Aβ sono considerate fibre nervose grandi, mentre le fibre Aδ e C sono considerate fibre nervose piccole. Tra le fibre piccole, le fibre Aδ mielinizzate mostrano velocità di conduzione maggiori (da 4 a 36 m/s) rispetto alle fibre C non mielinizzate (da 0,4 a 2,8 m/s).[9] Questa differenza è dovuta al diametro maggiore e alla presenza della mielina.[10]
La NPF è definita come una disfunzione di queste piccole fibre Aδ e C, che ha luogo attraverso un meccanismo non chiaro. È improbabile che i processi demielinizzanti rappresentino la patogenesi sottostante in quanto non colpiscono solo le piccole fibre. Si ritiene quindi che la perdita assonale distale o la degenerazione neuronale siano la causa sottostante più probabile della NPF.[5]
Anamnesi ed esame obiettivo
Un’anamnesi e un esame obiettivo approfonditi sono fondamentali per la valutazione della NPF. I pazienti con NPF spesso presentano inizialmente sintomi sensoriali, tra cui dolore, bruciore, intorpidimento e formicolio. Anche se la maggior parte dei casi di NPF presenta uno schema lunghezza-dipendente (sintomi che iniziano dai piedi e progrediscono in senso prossimale), alcuni seguono uno schema non lunghezza-dipendente (distribuzione prossimale, diffusa o a chiazze che coinvolge diverse parti del corpo tra cui bocca, viso, tronco, cuoio capelluto o arti superiori prima o simultaneamente al coinvolgimento degli arti inferiori) o una neuropatia asimmetrica singola o multipla (coinvolgimento di uno o più nervi periferici sensoriali, spesso con sindrome della bocca urente, vulvodinia o notalgia e meralgia parestetica).[3]
La NPF lunghezza-dipendente spesso è dovuta a cause metaboliche, tra cui diabete o esposizione a sostanze neurotossiche, mentre la NPF non lunghezza-dipendente è spesso dovuta a disturbi paraneoplastici e patologie immuno-mediate come la sindrome di Sjögren.[11]
I pazienti con NPF spesso presentano inizialmente dolore neuropatico ai piedi. I sintomi possono essere lievi all’esordio e alcuni pazienti notano un fastidio vago ai piedi. Le descrizioni riportate possono includere intorpidimento delle dita dei piedi, sensazione di avere i piedi di legno o una sensazione che il paziente descrive come camminare sulla sabbia, su palline da golf o su ciottoli. Il dolore urente ai piedi che si espande in direzione prossimale con una distribuzione a calza e a guanto è spesso il sintomo più fastidioso e tipico.
Questo bruciore è spesso accompagnato da dolore pungente, sensazione di spilli e aghi, scosse elettriche o crampi a piedi e polpacci. I pazienti con NPF tipicamente presentano i sintomi peggiori di notte e spesso lamentano gambe senza riposo, intolleranza alle lenzuola e allodinia o disestesia causate dai vestiti. Alcuni pazienti non riferiscono dolore ma notano una sensazione di gonfiore e costrizione ai piedi. Il coinvolgimento delle fibre autonomiche può portare a sintomi aggiuntivi tra cui bocca secca, occhi secchi, stipsi, incontinenza vescicale, intolleranza ortostatica, disfunzione sessuale, colorazione rossastra o biancastra della pelle o disturbi della sudorazione.
Dopo la presentazione iniziale, è necessario ottenere un’anamnesi dettagliata, che includa anamnesi farmacologica, familiare, uso di alcool e uso di farmaci neurotossici come colchicina, metronidazolo e chemioterapici.[2]
Vista l’associazione nota tra NPF e malattie come l’epatite C e il virus dell’immunodeficienza umana (HIV), chi esamina il paziente deve indagare su fattori di rischio rilevanti come abitudini sessuali, uso di droghe per via endovenosa e trasfusioni di sangue. Un esame obiettivo neurologico approfondito può distinguere la neuropatia delle piccole fibre da quella delle grandi fibre.
L’esame spesso mostra allodinia, iperalgesia o riduzione della percezione termica e di puntura. Riscontri quali debolezza, riduzione della propriocezione e assenza di riflessi tendinei profondi non devono essere presenti nella NPF e indicano invece un coinvolgimento delle grandi fibre. Quando l’anamnesi permette di sospettare un coinvolgimento delle fibre autonomiche, devono essere controllati i segni vitali per indagare la presenza di ipotensione ortostatica e deve essere controllata la pelle, che può apparire secca, brillante, atrofica, di colore anomalo o leggermente adenomatosa a causa di anomalie vasomotorie o sudomotorie. Un esame obiettivo deve anche valutare tutti i disturbi sistemici precedentemente menzionati noti per essere associati alla NPF.
Valutazione
La valutazione diagnostica per una sospetta NPF prevede svariati esami. Anche se gli studi di conduzione nervosa e la EMG con aghi dimostrano solo il coinvolgimento delle grandi fibre portando a risultati normali in pazienti con coinvolgimento isolato delle piccole fibre, questi esami possono essere utili per valutare il coinvolgimento subclinico di grandi fibre nervose e diagnosi alternative, inclusa la radicolopatia lombosacrale.
Gli impulsi lungo le piccole fibre viaggiano troppo lentamente e le loro risposte di conduzione non possono essere acquisite in uno studio di conduzione nervosa, che è un esame di routine eseguito per valutare le grandi fibre nervose sensoriali e motorie. Viene quindi spesso usata una biopsia cutanea per valutare le piccole fibre nervose sensoriali presenti nella pelle. La biopsia cutanea è una procedura minimamente invasiva che può essere usata anche per valutare la densità delle fibre nervose intraepidermiche. I campioni cutanei vengono generalmente ottenuti con una biopsia punch di 3 mm sulla gamba prossimale e sulla coscia e vengono inviati a un laboratorio per l’analisi. La NPF può essere diagnosticata se la densità delle fibre nervose intraepidermiche è inferiore al normale. La biopsia cutanea ha una sensibilità dell’88% nella diagnosi di NPF.[12]
Un altro esame che può essere eseguito è il test del riflesso assonale sudomotorio quantitativo (QSART), uno studio autonomico non invasivo usato per valutare il volume di sudore prodotto negli arti in risposta all’acetilcolina. Il QSART può misurare la funzionalità dei nervi sudomotori simpatici postgangliari e può avere una sensibilità fino all’80% nella diagnosi di NPF.[13]
Altri esami diagnostici utili possono includere il tilt-test e il test cardiovagale per i pazienti con palpitazioni e ipotensione ortostatica e il test del sudore termoregolatore per i pazienti con sudorazione anormale.
La diagnosi di NPF resta difficile in quanto non è ancora disponibile un test standard di riferimento. Anche se alcune fonti hanno suggerito che la presenza di almeno due riscontri anormali, tra cui presentazione clinica, test sensoriali quantitativi (QST) e biopsia cutanea, è il miglior criterio diagnostico per la NPF, alcune fonti hanno incluso il QSART invece della biopsia cutanea per la diagnosi.[14][15]
Anche se fino a metà dei casi di NPF è considerata idiopatica, è importante cercare di trovare la causa sottostante per identificare un possibile trattamento.[16] Gli esami possono includere:
Studi di primo livello
- Emocromo completo per eventuali anomalie ematologiche
- Panello metabolico completo per un’eventuale compromissione renale o epatica
- Pannello lipidico per un’eventuale iperlipidemia
- Velocità di eritrosedimentazione, proteina C reattiva e anticorpi antinucleo per eventuali malattie infiammatorie
- Ormone tireostimolante, livelli di T4 e T3 libere per un eventuale ipotiroidismo
- Test di tolleranza orale al glucosio di 2 ore ed emoglobina A1C per eventuale diabete e alterata tolleranza al glucosio
- Test degli antigeni nucleari estraibili A e B per la sindrome di Sjögren
- Vitamina B12, acido metilmalonico e livelli di omocisteina per un’eventuale carenza di vitamina B12 Transglutaminasi tissutale e anticorpi antigliadina per un’eventuale celiachia
- Anticorpi contro il virus dell’immunodeficienza umana (HIV) e il virus dell’epatite C per eventuale HIV ed epatite
Studi di secondo livello
- Enzima di conversione dell’angiotensina per un’eventuale sarcoidosi
- Tiamina (vitamina B1) per un’eventuale carenza di vitamina B1
- Piridossina (vitamina B6) per un’eventuale carenza di vitamina B6
- Livello di rame per un’eventuale carenza di rame
- Analisi delle proteine monoclonali sieriche e urinarie, biopsia nervosa e analisi del cuscinetto adiposo per un’eventuale amiloidosi sistemica
- Pannello degli autoanticorpi paraneoplastici per un’eventuale malattia paraneoplastica
- Anticorpi antirecettore dell’acetilcolina gangliare per un’eventuale ganglionopatia autonomica autoimmune
Studi genetici
- Geni SCN9A e SCN10A per un’eventuale neuropatia delle piccole fibre ereditaria
- Gene GLA per un’eventuale malattia di Fabry
- Gene della transtiretina per un’eventuale amiloidosi familiare
- Gene ABCA1 per un’eventuale malattia di Tangier
Trattamento / Gestione
La gestione della NPF dovrebbe prevedere il trattamento della causa sottostante nei pazienti con causa identificata di neuropatia. Il diabete deve essere gestito non solo con prodotti per ridurre la glicemia e i lipidi ma anche con modifiche dello stile di vita che si incentrino in particolare su alimentazione ed esercizio fisico. Poiché camminare e correre possono essere difficili per i pazienti con NPF a causa del dolore, possono essere eseguiti esercizi alternativi, tra cui terapia in acqua, nuoto e cyclette.
In caso di carenza di vitamina B12, è spesso raccomandata l’integrazione parenterale piuttosto che orale in quanto la carenza è più spesso dovuta ad assorbimento ridotto che a un basso apporto con la dieta. Un regime suggerito potrebbe consistere in iniezioni intramuscolari o sottocutanee di 1.000 μg di metilcobalamina una volta al giorno per una settimana, seguite da una volta alla settimana per un mese, seguite da una dose di mantenimento mensile per i 6-12 mesi successivi.
Come da rapporti aneddotici di casi, NPF dolorosa e disautonomia secondarie a sindrome di Sjögren sono state trattate con successo con corticosteroidi, immunoglobuline endovenose (IVIG) e altri immunosoppressori.[17]
La NPF associata a sarcoidosi può anche essere trattata con IVIG, con infliximab e con una terapia di associazione.
[18] I pazienti con NPF secondaria a celiachia possono trovare sollievo dai sintomi della NPF con una dieta senza glutine.
La gestione del dolore è importante nel trattamento della NPF in quanto il dolore neuropatico può essere debilitante e causare riduzione delle funzioni fisiche e depressione. Il dolore secondario a NPF è spesso trattato meglio da un team multidisciplinare, che può coinvolgere un medico di medicina generale, uno specialista in terapia del dolore, un neurologo e uno psichiatra. I farmaci usati nel trattamento della NPF includono anticonvulsivanti, antidepressivi, anestetici topici, narcotici, analgesici non narcotici e antiaritmici, mentre possono essere usati anche trattamenti non farmacologici come calore, ghiaccio, massaggio delle zone dolenti e stimolazione nervosa elettrica transcutanea (TENS).[19]
I farmaci di prima linea sono gli anticonvulsivanti gabapentin e pregabalin, gli antidepressivi triciclici amitriptilina e nortriptilina, l’analgesico oppioide semisintetico tramadolo e il cerotto di lidocaina topica al 5%. Questi farmaci possono essere usati da soli o in associazione. Possono essere usati anche gli antinfiammatori non steroidei e gli inibitori selettivi delle ricaptazione della serotonina ma spesso sono meno efficaci dei farmaci precedentemente menzionati. Il bloccante dei canali del sodio voltaggio-dipendenti mexiletina, generalmente usato come farmaco antiaritmico, può aiutare nel dolore refrattario correlato a disfunzione dei canali del sodio.[20]
Gli oppioidi devono essere riservati solo ai casi refrattari vista la possibile dipendenza; tuttavia, potrebbero talvolta essere necessari per pazienti con dolore debilitante che non rispondono ad altri farmaci. I regimi che combinano farmaci con meccanismi diversi potrebbero essere più efficaci. Uno studio che ha valutato un regime di trattamento che associava gabapentin e nortriptilina ha riscontrato che tale trattamento era più efficace di ciascun farmaco da solo per il trattamento del dolore neuropatico.[21]
Il trattamento con cannabis per inalazione ha dimostrato di ridurre il dolore in pazienti con neuropatia diabetica e HIV; sono, però, stati osservati effetti collaterali tra cui sonnolenza, euforia e compromissione cognitiva.[22] Terapie olistiche come yoga, tai chi e meditazione possono ridurre il dolore, migliorare la qualità della vita e l’equilibrio nei pazienti con neuropatia.[23]
In molti casi, la neuromodulazione si è dimostrata efficace nel trattare i sintomi dolorosi della NPF. I trattamenti includono stimolazione tradizionale della colonna dorsale, stimolazione del corno dorsale e stimolazione dei gangli radicolari dorsali.[24][25][26]
Diagnosi differenziale
Come precedentemente menzionato, è fondamentale distinguere la neuropatia delle piccole fibre da quella delle grandi fibre. Riscontri come debolezza, riduzione della propriocezione e assenza di riflessi tendinei profondi indicano un coinvolgimento delle grandi fibre (Aα e Aβ) e possono distinguere la neuropatia delle grandi fibre da quella delle piccole fibre.
L’EMG e gli studi di conduzione nervosa sono anch’essi utili in questa distinzione in quanto saranno normali in caso di coinvolgimento delle piccole fibre e anormali in caso di coinvolgimento delle grandi fibre. L’EMG può anche permettere di distinguere la NPF dalla radicolopatia lombare che può anch’essa presentarsi con bruciore e intorpidimento degli arti inferiori. La distinzione tra queste condizioni è fondamentale per implementare un regime terapeutico corretto, in quanto la loro gestione è diversa.
Prognosi
La maggior parte dei pazienti con NPF presenta un decorso lentamente progressivo, con un plateau clinico raggiunto dopo anni di sviluppo dei sintomi. Uno studio ha mostrato che solo il 13% di 124 pazienti con NPF aveva sviluppato segni di coinvolgimento delle grandi fibre in un periodo di due anni.[27]
Lo stesso studio ha riscontrato che nessuno dei pazienti ha sviluppato artropatia neuropatica, debolezza, atassia sensoriale o ulcere ai piedi, che sono sintomi tipicamente osservati in pazienti con neuropatia delle grandi fibre cronica o grave. È stato inoltre osservato che più della metà dei pazienti o è migliorata o è rimasta stabile nei due anni. Ulteriori studi sarebbero utile per valutare la progressione dei sintomi in un periodo più lungo di due anni.
Complicanze
Il rischio di complicanze nei pazienti con NPF spesso varia in base alla causa sottostante. Deve essere ricercato e implementato un trattamento corretto per prevenire la progressione della malattia correlata alle condizioni mediche sottostanti. Il dolore provocato dalla NPF può anche causare disfunzione e inattività nei pazienti. Per questo motivo, un controllo adeguato del dolore è fondamentale per il proseguimento dell’attività fisica al fine di prevenire complicanze dell’inattività, tra cui aumento di peso e depressione.
Educazione del paziente
I pazienti a cui viene diagnosticata la NPF devono essere educati riguardo a strategie per ridurre il carico del dolore neuropatico e alla gestione corretta delle possibili condizioni sottostanti.
- I pazienti diabetici devono essere educati riguardo a dieta, esercizio fisico e insulina (se necessaria). Un follow-up ambulatoriale regolare deve essere organizzato con medico di base, podologo, oftalmologo, endocrinologo e cardiologo.
- I pazienti con NPF secondaria all’alcool devono ricevere risorse per astenersi dall’alcool.
- I pazienti con carenze nutrizionali come carenza di vitamina B12 devono essere educati a un’integrazione corretta.
- I pazienti con NPF da cause infettive come HIV, Lyme ed epatite C devono essere educati riguardo al trattamento antivirale corretto per la loro infezione sottostante.
- I pazienti con NPF da cause immunomediate ed ereditarie devono essere educati riguardo a strategie di trattamento e altre possibili complicanze correlate alla loro condizione sottostante.
Oltre all’educazione riguardo alla gestione corretta delle condizioni sottostanti correlate alla NPF, si deve enfatizzare l’importanza di proseguire l’attività fisica.
Miglioramento degli esiti dei team sanitari
Una forte relazione tra il medico e il paziente è fondamentale per migliorare gli esiti dell’assistenza sanitaria. È fondamentale una buona comunicazione nel team interprofessionale, che può includere un neurologo, un terapista del dolore, un fisiatra, un medico di medicina generale, un dietologo e un infermiere.
La NPF può causare dolore debilitante senza una corretta gestione, il che spesso conduce a decondizionamento e depressione. Trattamento specifico per la causa, controllo del dolore e modifiche dello stile di vita sono elementi fondamentali nell’approccio del team alla gestione della neuropatia delle piccole fibre.
Autori: Matthew A. Cascio; Taif Mukhdomi Fonte: https://www.ncbi.nlm.nih.gov/books/NBK582147